Arbeitsgruppe Klotz
Unsere Arbeitsgruppe befasst sich mit der übergeordneten Fragestellung, welche Mechanismen entzündliche Prozesse im Kontext verschiedener neurologischer Erkrankungen steuern und wie diese Mechanismen therapeutisch gezielt moduliert werden können. Hierbei interessieren wir uns sowohl für Mechanismen, die eine schädliche entzündliche Überaktivierung von Immunzellen kontrollieren und hemmen als auch für solche, welche gezielt anti-inflammatorische und regulatorische Funktionen verschiedener Immunzellen verstärken. Letztlich soll unsere Forschung dazu beitragen, die Entstehung von Erkrankungen wie der Multiplen Sklerose oder der Neuromyelitis Optica zu entschlüsseln, sowie hieraus neue Therapieansätze zu identifizieren und andererseits von neuen und bestehenden Therapiekonzepten Rückschlüsse auf die Pathophysiologie dieser Erkrankungen zu ziehen. Neben dem gesamten Spektrum entzündlicher Erkrankungen des Nervensystems interessieren wir uns für entzündliche Prozesse in Rahmen anderer neurologischer Erkrankungen wie z.B. dem Schlaganfall.
Als clinician scientist ist Prof. Klotz hierbei eine enge und kontinuierliche Verzahnung von Grundlagenforschung und klinischer Translation ein besonderes Anliegen. Zur Beantwortung unserer wissenschaftlichen Fragestellungen verwenden wir daher eine große Bandbreite an Methoden, von tierexperimentellen Ansätzen über Untersuchungen an humanen Immunzellen bis hin zur Durchführung eigener wissenschaftlich ausgerichteter klinischer Studien.
Für eine optimale Nutzung klinischer Studien und Projekte zur Beantwortung wissenschaftlicher Fragestellungen haben wir in unserer Klinik eine experimentelle Plattform aufgebaut, die es ermöglicht, bestimmte immunologische Methoden in hochstandardisierter Weise je nach Fragestellung modular miteinander zu kombinieren und zu nutzen.
Durch dieses Angebot sollen wertvolle Daten aus Patientenkohorten für die Beantwortung wissenschaftlicher Fragestellungen besser nutzbar gemacht werden.
Folgende Themen werden in meiner Arbeitsgruppe aktuell schwerpunktmäßig bearbeitet:
Einfluss von Ernährungsfaktoren auf autoimmune Prozesse des Nervensystems
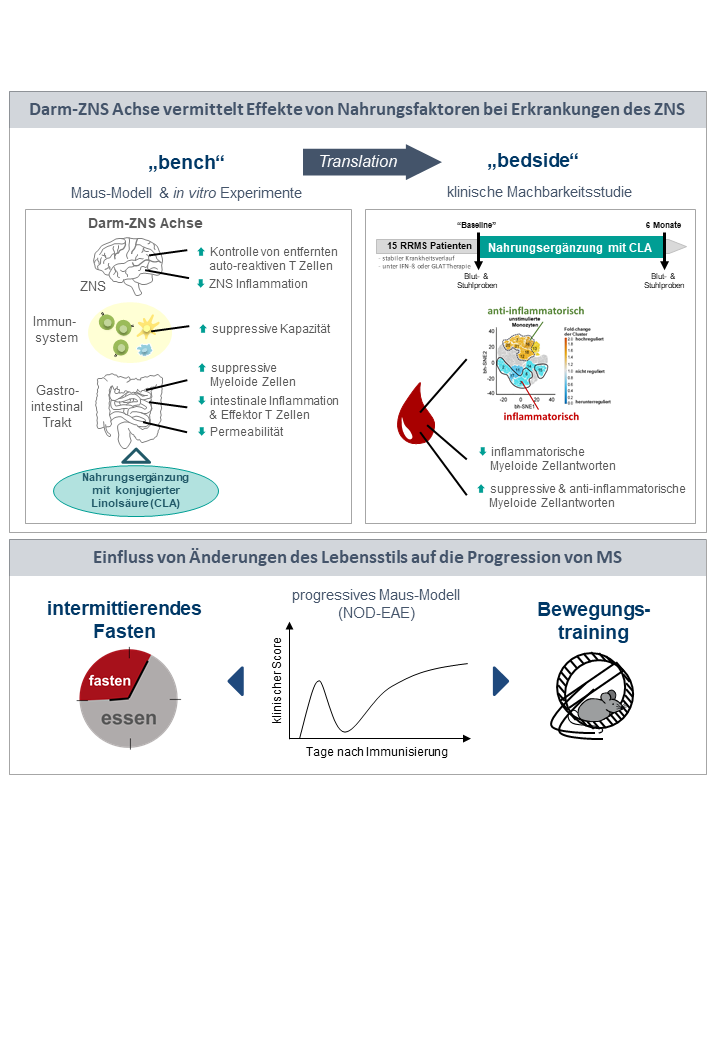
In den vergangenen Jahren ist die Bedeutung von Umwelteinflüssen auf die Entstehung und den Krankheitsverlauf von Autoimmunerkrankungen wie der Multiplen Sklerose mehr und mehr in den Mittelpunkt des wissenschaftlichen Interesses gerückt. Die hier diskutierten Umwelteinflüsse reichen von gezielten Ernährungsmodifikationen über UV-Licht bis hin zu viralen Triggern der Erkrankung. Ein wichtiges Kommunikationsmittel zwischen der Ernährung und dem zentralen Nervensystem stellt die Darm-ZNS-Achse dar, welche verschiedene direkte und indirekte Kommunikationswege über endokrine, immunologische sowie nervale Wege vom Darm ins ZNS umfasst. Hierbei können sowohl spezifische Nahrungsbestandteile oder deren aktive Komponenten eine direkte modulatorische Funktion übernehmen oder über eine Veränderung der Zusammensetzung der Darmflora (auch Mikrobiom genannt) immunologische Prozesse im Darm sowie im Körper beeinflussen.
Wir untersuchen im Rahmen einer Förderung durch die DFG im Sonderforschungsbereich SFB TR128 „Multiple Sklerose“ die protektiven Effekte einer Nahrungsergänzung mit konjugierter Linolsäure, CLA. Neben grundlagenwissenschaftlichen Untersuchungen zur Erforschung der genauen Mechanismen der Immunmodulation durch CLA führen wir eigene wissenschafts-initiierte klinische Studien durch, um die klinische Relevanz unseres Ansatzes für Patienten adressieren zu können.In einem weiteren IMF-geförderten Forschungsprojekt untersuchen wir den Einfluss von Ausdauersport und intermittierendem Fasten auf die progrediente Krankheitsphase in einem Modell der sekundär chronisch progredienten MS.
Rolle von T Zellen in der Pathophysiologie der Neuromyelitis Optica
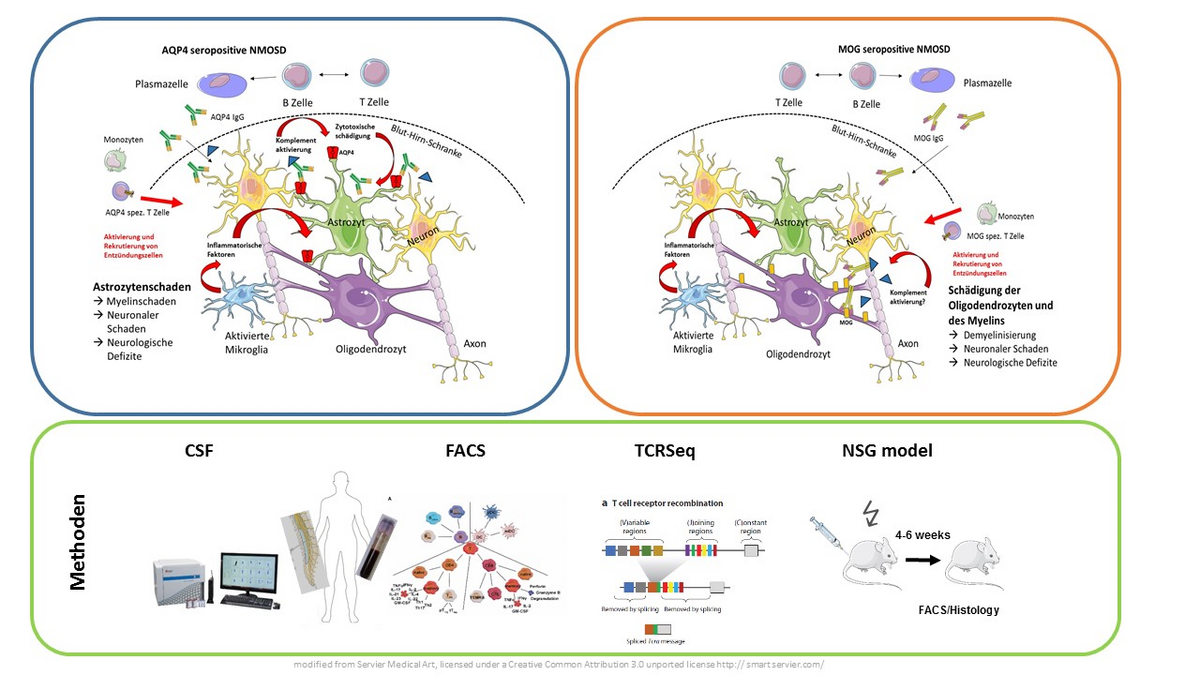
Bei der Neuromyelitis Optica (NMO) handelt es sich um eine seltene Autoimmunerkrankung des zentralen Nervensystems, bei der von B Zellen produzierte Autoantikörper gegen das Wasserkanal-Protein Aquaporin-4 eine große Rolle spielen. Neben der zentralen Bedeutung von B Zellen finden sich jedoch auch Hinweise für eine Rolle fehlregulierter T Zell Antworten als weiteren relevanten Pathomechanismus der Erkrankung. Wir erforschen die Bedeutung dieser fehlregulierten T Zell Antworten bei der NMO in enger Zusammenarbeit mit der Neuromyelitis Optica Studiengruppe (NEMOS) unter Verwendung eines breiten Methodenspektrums einschließlich Durchflußzytometrie des Liquor Cerebrospinalis, immunologischer Charakterisierung der T Zellen im peripheren Blut sowie Analyse des T Zell Rezeptor Repertoires und der transkriptionellen Muster in T Zellen von NMO Patienten. Ein besonderes Interesse haben wir an der vergleichenden Analyse von Patienten mit Aquaporin-4 positiver Neuromyelitis Optika und Patienten mit MOG-Antikörper assoziierten Erkrankungen, einer recht neu definierten verwandten Krankheitsentität.
Immunmetabolismus und Immunregulation
In den letzten Jahren sind energetisch relevante Stoffwechselprozesse wie die mitochondriale Atmung und die Glykolyse in Immunzellen als zentrale Schaltstelle der Regulation von Immunantworten identifiziert worden. Neben ihrer physiologischen Funktion im Rahmen von Immunantworten sind auch Störungen des Energiestoffwechsels in Immunzellen bei Autoimmunerkrankungen sowie schweren Infektionserkrankungen beschrieben worden. Ein Schwerpunkt unserer Arbeit ist es, Veränderungen des Energiestoffwechsels als Pathomechanismus bei neurologischen Erkrankungen zu charakterisieren und hieraus neue therapeutische Ansatzpunkte ableiten zu können (Liebmann et al. PNAS 2018, Klotz et al. 2019).
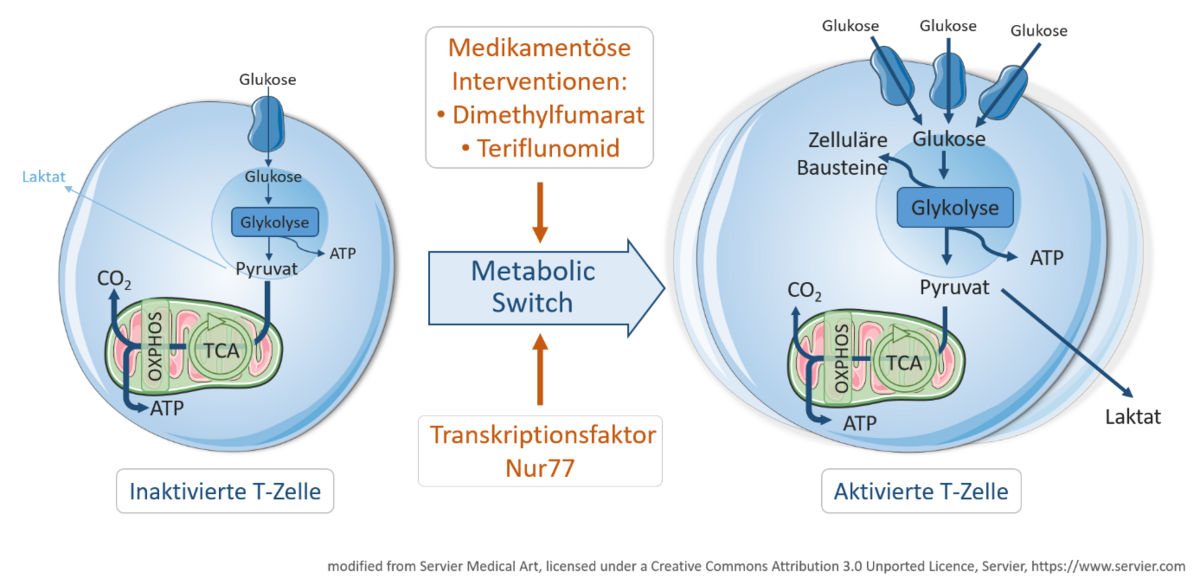
Beispielhaft soll hier erwähnt werden, dass wir erstmals zeigen konnten, dass T Zellen von MS Patienten während eines akuten Krankheitsschubes einen deutlich gesteigerten Energiestoffwechsel aufweisen im Vergleich zu stabilen Krankheitsphasen (Klotz et al, Sci Transl Med 2019).
Interessanterweise sind die immunmodulatorischen Effekte einiger zugelassener Medikamente zur Behandlung der MS zumindest teilweise durch ein gezieltes Eingreifen in den Energiestoffwechsel von Immunzellen zu erklären (Klotz et al, Sci Transl Med 2019).
Neben Projekten zur Autoimmunität des zentralen Nervensystems untersuchen wir diese Mechanismen auch im Kontext akuter inflammatorischer Prozesse beim Schlaganfall (Forschergruppe Immunostroke, DFG Research Unit FOR 2879, From immune cells to stroke recovery) sowie der klinischen Forschungsgruppe Organ Dysfunction during Systemic Inflammation, KFO342 – Bridging Basic Science and Clinical Research.Identifizierung krankheitsspezifischer Immunsignaturen
Die Identifizierung krankheitsspezifischer Signaturen sowie möglicher Prognosemarker anhand des peripheren Blutes bei MS Patienten stellt einen weiteren wissenschaftlichen Schwerpunkt unserer Arbeit dar. Mittels hochauflösender Vielfarben-Durchflusszytometrie ist es uns möglich, eine genaue Kartierung der Zusammensetzung der Immunzellen im peripheren Blut zu erstellen. Anhand einer weltweit einmaligen Münchener Kohorte eineiiger Zwillinge, bei denen jeweils ein Zwilling an MS erkrankt ist und einer gesund ist, konnten wir mit unserer Methode kürzlich frühe Marker einer entstehenden MS Erkrankung identifizieren (Gerdes et al. PNAS 2020).
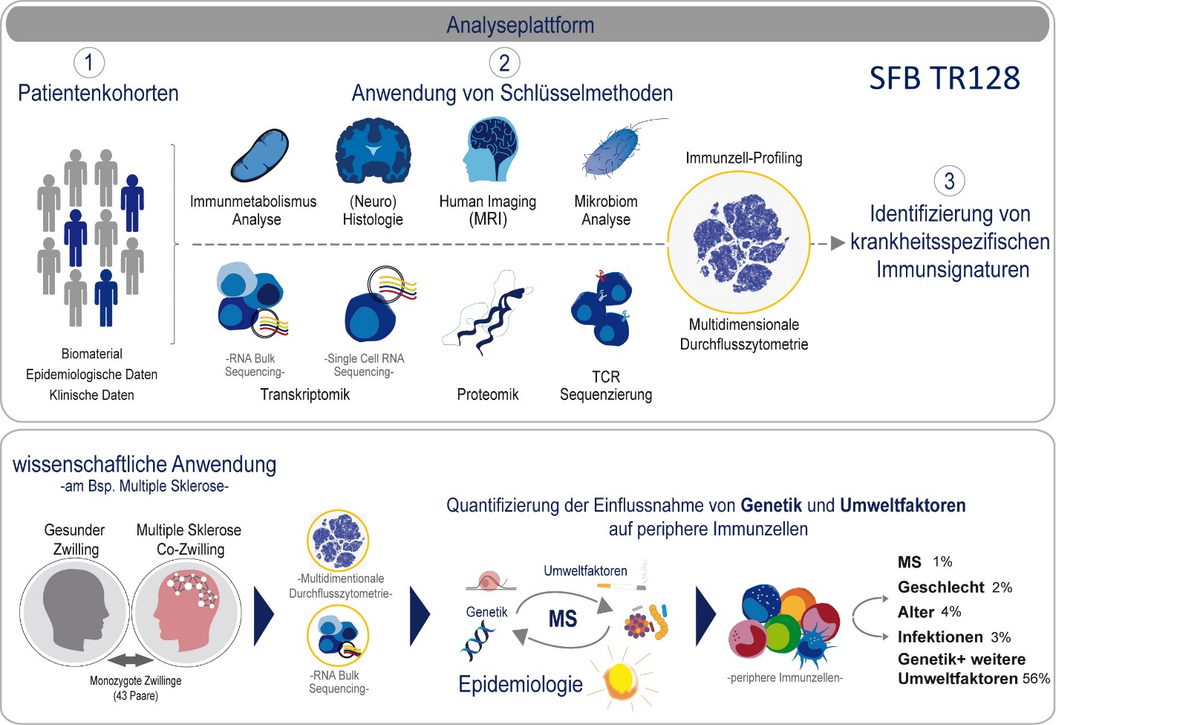
In einem Folgeprojekt werden aktuell unterschiedliche Signaturen auf transkriptioneller Ebene untersucht um die funktionellen Veränderungen in T Zellen im Rahmen eines MS „Prodromalstadiums“ besser zu verstehen. Dieses Projekt wird gefördert durch den SFB TR128.
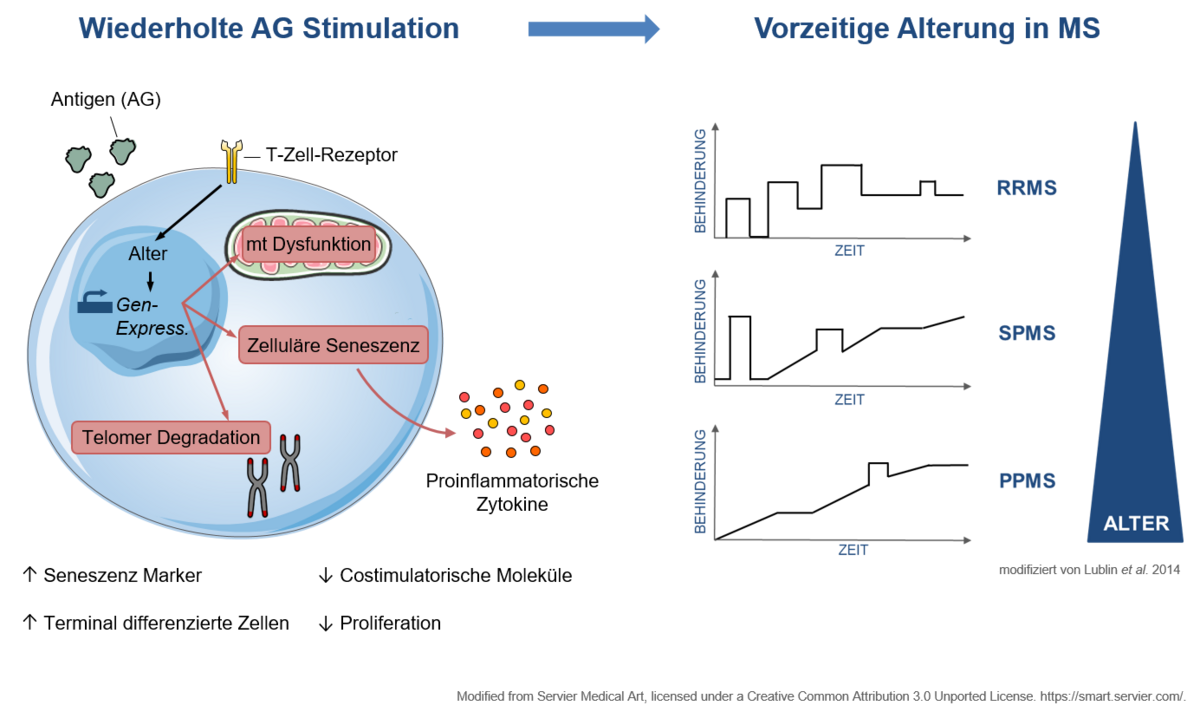
Immunseneszenz
Ein weiterer Schwerpunkt unserer Arbeit liegt in der Charakterisierung der Immunseneszenz, also eines vorzeitigen Alterungsprozesses in Immunzellen mit begleitender Funktionseinschränkung bei entzündlichen Erkrankungen des Nervensystems. Eine vorzeitige Immunalterung, das sogenannte „ImmuneAging“ wurde bereits bei einer Reihe immunologischer Systemerkrankungen wie dem systemischen Lupus erythematodes beschrieben. Bei der Multiplen Sklerose gibt es ebenfalls Hinweise auf vergleichbare Prozesse, dies ist jedoch bisher nicht eingehend charakterisiert. Aus klinischer Perspektive ist dieses Phänomen hochrelevant, da eine rezente Metaanalyse zeigt, dass die Wirksamkeit von Immuntherapien mit zunehmendem Alter der Patienten nachlässt. Dies ist insbesondere vor dem Hintergrund des steigenden Alters unserer Patienten klinisch relevant. Diese Fragestellungen bearbeiten wir mit einem breiten Methodenspektrum aus Vielfarben-Durchflusszytometrie von peripherem Blut und Liquor cerebrospinalis von Patienten zur Charakterisierung des Ausmaßes der Immunalterung, mechanistischen Untersuchungen an humanen Immunzellen zum besseren Verständnis der zugrundeliegenden zellulären Prozesse, sowie tierexperimentellen Studien zur Charakterisierung hieraus abgeleiteter neuer Behandlungsansätze. Die Projekte werden gefördert durch die Deutsche Multiple Sklerose Gesellschaft, Bundesverband e.V. (DMSG) und das Programm "Innovative Medizinische Forschung" (IMF) der Medizinischen Fakultät Münster.
Blut-Hirn-Schranke
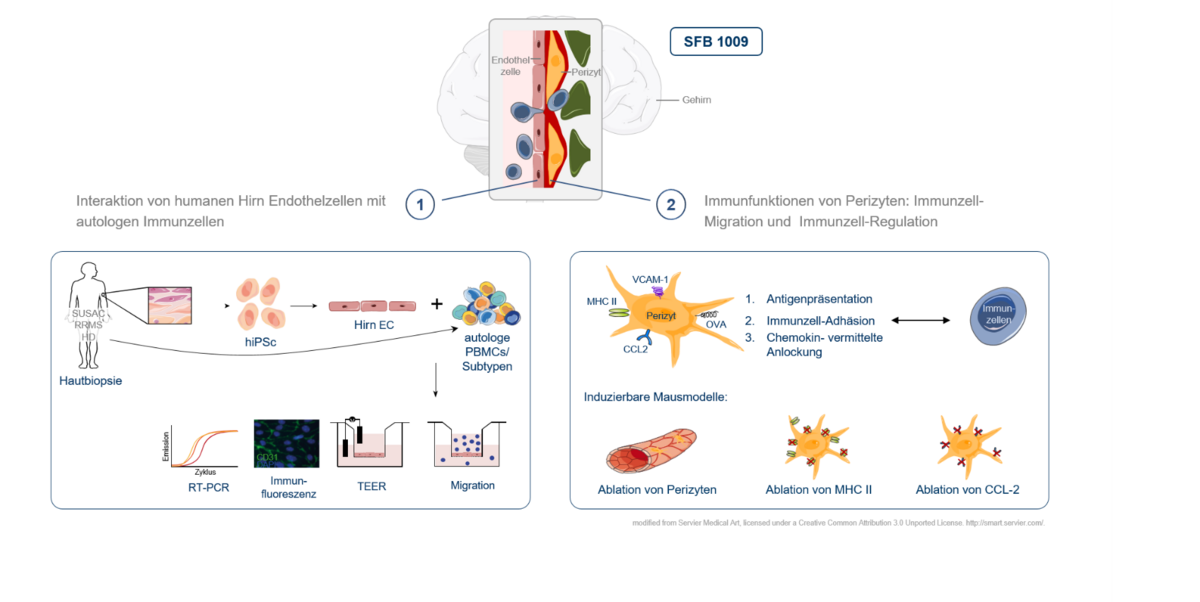
Die Wanderung von Immunzellen aus dem Blut über die Blut-Hirn-Schranke (BHS) stellt einen Schlüsselschritt in der Pathogenese verschiedener entzündlicher Erkrankungen des zentralen Nervensystems dar und ist bereits Ansatzpunkt erfolgreicher etablierter Therapiestrategien wie des monoklonalen Antikörpers Natalizumab. Neben der reinen Barrierefunktion gibt es jedoch Hinweise dafür, dass die durchwandernden Immunzellen bei ihrer Interaktion mit den zellulären Komponenten der BHS wichtige Signale erhalten, die das Wanderungsverhalten und den Aktivitätszustand der Immunzellen und damit den weiteren Verlauf des folgenden entzündlichen Prozesses beeinflussen. Im Rahmen des Sonderforschungsbereichs „breaking barriers“ befassen wir uns mit diesen Interaktionen zwischen Immunzellen und dem Endothel der BHS einerseits und den Perizyten als zweiter wichtiger zellulärer Komponente der BHS andererseits. Im Fokus stehen hier eine Kombination aus tierexperimentellen Modellen, Zellkultur Modellen sowie Modellen unter Verwendung humaner Zellen nach deren Differenzierung aus pluripotenten induzierbaren Stammzellen. Das Projekt wird gefördert durch den SFB 1009 „breaking barriers“.
Ausgewählte Publikationen
Klotz L*, Smolders J*, Lehto J, Matilainen M, Lütje L, Buchholz L, Albrecht S, Walter C, Varghese J, Wiendl H, Nylund M, Thomas C, Gardberg M, van den Bosch AMR, Airas L*, Huitinga I*, Kuhlmann T*. (2025) Broad rim lesions are a new pathological and imaging biomarker for rapid disease progression in multiple sclerosis. Nat Med 2025 Jun;31(6):2016-2026. (*shared first/last authorship)
Gross CC*, Schulte-Mecklenbeck A*, Steinberg OV*, Wirth T*, Lauks S*, Bittner S*, Schindler P, Baranzini SE, Groppa S, Bellmann-Strobl J, Bünger N, Chien C, Dawin E, Eveslage M, Fleischer V, Gonzalez-Escamilla G, Gisevius B, Haas J, Kerschensteiner M, Kirstein L, Korsukewitz C, Lohmann L, Lünemann JD, Luessi F, Meyer zu Hörste G, Motte J, Ruck T, Ruprecht K, Schwab N, Steffen F, Meuth SG, Paul F, Wildemann B, Kümpfel T, Gold R, Hahn T, Zipp F, Klotz L*, Wiendl H*, KKNMS (2024) Multiple sclerosis endophenotypes identified by high-dimensional blood signatures are associated with distinct disease trajectories. Sci Transl Med 16(740):eade8560. (*shared first/last authorship)
Klotz L, Antel J, Kuhlmann T (2023) Inflammation in multiple sclerosis: consequences for remyelination and disease progression. Nat Rev Neurol. 19(5):305-320.
Janoschka C, Lindner M, Koppers N, Starost L, Liebmann M, Eschborn M, Schneider-Hohendorf T, Windener F, Schafflick D, Fleck AK, Koch K, Deffner M, Schwarze AS, Schulte-Mecklenbeck A, Metz I, Meuth SG, Gross CC, Meyer zu Hörste G, Schwab N, Kuhlmann T, Wiendl H, Stoll M, Klotz L.(2023) Enhanced pathogenicity of Th17 cells due to natalizumab treatment-implications for MS disease rebound. Proc Natl Acad Sci USA 120(1):e2209944120.
Liebmann M, Korn L, Janoschka C, Albrecht S, Lauks S, Herrmann AM, Schulte-Mecklenbeck A, Schwab N, Schneider-Hohendorf T, Eveslage M, Wildemann B, Luessi F, Schmidt S, Diebold M, Bittner S, Gross CC, Kovac S, Zipp F, Derfuss T, Kuhlmann T, König S, Meuth SG, Wiendl H, Klotz L. (2021) Dimethyl fumarate treatment restrains the antioxidative capacity of T cells to control Autoimmunity. Brain 144(10):3126–3141.
Fleck AK, Hucke S, Teipel F, Eschborn M, Janoschka C, Liebmann M, Wami H, Korn L, Pickert G, Hartwig M, Wirth T, Herold M, Koch K, Falk-Paulsen M, Dobrindt U, Kovac S, Rosenstiel P, Trautmann M, Wiendl H, Schuppan D, Kuhlmann T, Klotz L. (2021) Dietary CLA links reduced intestinal inflammation to amelioration of CNS-autoimmunity. Brain 144(4):1152–1166
Gerdes LA, Janoschka C, Eveslage M, Mannig B, Wirth T, Schulte-Mecklenbeck A, Lauks S, Glau L, Gross CC, Tolosa E, Flierl-Hecht A, Ertl-Wagner B, Barkhof F, Meuth SG, Kumpfel T, Wiendl H, Hohlfeld R, Klotz L. (2020) Immune signatures of prodromal multiple sclerosis in monozygotic twins. Proc Natl Acad Sci U S A. 117: 21546-21556.
Klotz L, Eschborn M, Lindner M, Liebmann M, Herold M, Janoschka C, Torres Garrido B, Schulte-Mecklenbeck A, Gross CC, Breuer J, Hundehege P, Posevitz V, Pignolet B, Nebel G, Glander S, Freise N, Austermann J, Wirth T, Campbell GR, Schneider-Hohendorf T, Eveslage M, Brassat D, Schwab N, Loser K, Roth J, Busch KB, Stoll M, Mahad DJ, Meuth SG, Turner T, Bar-Or A, Wiendl H. (2019) Teriflunomide treatment for multiple sclerosis modulates T cell mitochondrial respiration with affinity-dependent effects. Sci Transl Med 11(490): eaao5563.
Liebmann M, Hucke S, Koch K, Eschborn M, Ghelman J, Chasan AI, Glander S, Schädlich M, Kuhlencord M, Daber NM, Eveslage M, Beyer M, Dietrich M, Albrecht P, Stoll M, Busch KB, Wiendl H, Roth J, Kuhlmann T, Klotz L (2018) Nur77 serves as a molecular brake of the metabolic switch during T cell activation to restrict autoimmunity. PNAS; 115 (34) E8017-E8026.
Lohmann L, Janoschka C, Schulte-Mecklenbeck A, Klinsing S, Kirstein L, Hanning U, Wirth T, Schneider-Hohendorf T, Schwab N, Gross CC, Eveslage M, Meuth SG, Wiendl H, Klotz L. (2018) Immune Cell Profiling During Switching from Natalizu-mab to Fingolimod Reveals Differ Effects on Systemic Immune-Regulatory Networks and on Traficking of Non-T Cell Populations into the Cerebrospinal Fluid-Results from the ToFingo Successor Study. Front Immunol 9:1560.
Förderung
Deutsche Forschungsgesellschaft (DFG): Next-generation immunological analysis of a cohort of monozygotic twins discordant for Multiple Sclerosis diagnosis
Deutsche Forschungsgesellschaft (DFG): Organdysfunktion im Rahmen systemischer Inflammationssyndrome. Projekttitel: Immunsystemvariablen bei gesunden Probanden und im Rahmen systemischer Entzündungen
Deutsche Forschungsgesellschaft (DFG): ImmunoStroke: From immune cells to stroke recovery, Projekttitel: Linking functional immune profile and ischemic lesion characteristics in human stroke
Deutsche Forschungsgesellschaft (DFG): Die Rolle des nukleären Rezeptors NR4A1 beim akuten ischämischen Schlaganfall: Pathophysiologie, Therapieevaluation und humane Translation
Interdisziplinäres Zentrum für klinische Forschung (IZKF) Münster: Antigen-specific CD8 T cell responses in Neuromyelits Optica and Susac Syndrome
Innovative Medizinische Forschung (IMF) Münster: Farnesoid X receptor (FXR)-induced anti-inflammatory monocyte polarization relevance for autoimmunity
Deutsche Forschungsgesellschaft (DFG): CRC 128 Initiating/Effector versus Regulatory Mechanisms in Multiple Sclerosis – Progress towards tackling the disease (TP A8), Projekttitel: The nuclear receptors liver X receptor and farnesoid X receptor – bridging adaptive and innate immune-regulatory responses in Multiple Sclerosis (2012-2024)
Deutsche Forschungsgesellschaft (DFG): SFB1009 Breaking Barriers - Immunzellen und pathogene Erreger an Zell-/Matrix-Barrieren. Projekttitel: Immune-cell interactions with endothelial cells and pericytes at the blood-brain-barrier: mechanisms and consequences (2012-2024)
Kooperationen
lokal
- Univ.-Prof. Dr. rer. nat. Ralf Adams (Max-Planck-Institut für molekulare Biomedizin)
- Dr. med. Judith Alferink (Klinik für Psychiatrie und Psychotherapie)
- Univ.-Prof. Dr. med. Tanja Kuhlmann (Institut für Neuropathologie)
- Prof. Dr. med. Johannes Roth, Dr. rer. nat. Noelia Alonso-Gonzalez, Univ.-Prof. Dr. med. Thomas Vogl (Institut für Immunologie)
- Univ.-Prof. Dr. phil. nat. Guiscard Seebohm (Kardiologie, Institut für Genetik von Herzerkrankungen)
- Univ.-Prof. Dr. sc. hum. Monika Stoll (Institut für Humangenetik)
- Univ.-Prof. Dr. med. Alexander Zarbock, Dr. med. Jan Rossaint (Klinik für Anästhesiologie, operative Intensivmedizin und Schmerztherapie)
- Priv. Doz. Dr. med. Hannes Michael Findeisen (Innere Medizin und Kardiologie)
- Univ.-Prof. Dr. rer. nat. Rupert Hallmann, Univ.-Prof. Dr. rer. nat. Lydia Sorokin (Institut für Physiologische Chemie und Pathobiochemie)
- Priv. Doz. Dr. med. Sven Hermann (European Institute for Molecular Imaging (EIMI))
national
- Univ.-Prof. Dr. med. Orhan Aktas (Klinik für Neurologie, Universitätsklinikum Düsseldorf)
- Dr. Philipp Albrecht (Neurologische Klinik, Universitätsklinikum Düsseldorf)
- Dr. Lisa-Ann Gerdes, Prof. Dr. Reinhard Hohlfeld (Institut für Klinische Neuroimmunologie, Ludwig-Maximilians-Universität München)
- Prof. Dr. med. Sebastian Jander (Neurologische Klinik, Universitätsklinikum Düsseldorf)
- Prof. Dr. med. Martin Kerschensteiner (Institut für Klinische Neuroimmunologie, Universitätsklinikum München)
- Prof. Dr. Stefanie Kürten (Universität Würzburg)
- Dr. med. Marius Ringelstein (Klinik für Neurologie, Universitätsklinikum Düsseldorf)
- Prof. Dr. D. Schuppan (Universitätsmedizin der Johannes Gutenberg-Universität Mainz)
- Prof. Dr. med. Eva Tolosa (Institut für Immunologie, Universitätsklinikum Hamburg-Eppendorf)
- Prof. Dr. Brigitte Wildemann (Universitätsklinikum Heidelberg)

