Diagnostik

An unserem Institut wird das gesamte diagnostische und methodische Spektrum der Neuropathologie durchgeführt. Bearbeitet werden Biopsate von Tumoren des zentralen und peripheren Nervensystems, der umgebenden Weichteile und Knochen, Hirnbiopsien, Biopsate der Skelettmuskulatur und der peripheren Nerven, Liquor (für die qualitative Zytologie) und Dickdarmbiopsate (zur Untersuchung auf Aganglionose). Außerdem führen wir autoptische Untersuchungen von Gehirn und Rückenmark durch.
Das Institut ist nach den Anforderungen der DIN EN ISO/IEC 17020:2012 durch die Deutsche Akkreditierungsstelle — DAkkS GmbH — akkreditiert.
Für unsere Patienten
Wir untersuchen jedes Jahr Gewebeproben von etwa 5000 Patientinnen und Patienten. Es handelt sich dabei nicht nur um Tumoren, sondern unter anderem auch um entzündliche oder degenerative Prozesse. Falls eine Gewebeprobe von Ihnen am Institut für Neuropathologie untersucht wurde und Sie diese selber einmal am Mikroskop sehen möchten, zeigt sie Ihnen der Institutsdirektor gerne (kostenlos). Bitte vereinbaren Sie dazu einen Termin unter oder telefonisch unter 0251-83-56967.
Für einsendende Ärzte und Kliniken
Probenannahme: montags bis freitags 8:00 – 16:00 Uhr
Tel.: 0251-83-50444 oder 0251-83-56967; Fax: 0251-83-56971
Muskel- und Darmdiagnostik
Für die Muskel- und Darmdiagnostik wird natives (unfixiertes) Gewebe benötigt (bei Muskel ca. 2 x 1 x 1 cm großes Biopsat); natives Gewebe sollte innerhalb weniger Stunden in einer feuchten Kammer (aber nicht in einer Flüssigkeit schwimmend) und ggf. mit normalem Eis (kein Trockeneis) gekühlt (aber nicht gefroren) übersandt werden und bis spätestens 15:00 Uhr (Montag bis Freitag) bei uns eintreffen.
Nervendiagnostik
Nervenbiopsien sollten idealerweise ebenfalls nativ und ggf. gekühlt innerhalb weniger Stunden bei uns eintreffen. Falls dies nicht möglich ist, sollte der Nerv zur Hälfte in Formalin, zur anderen Hälfte in Glutaraldehyd (2.5%ig in Cacodylatpuffer) fixiert werden. Die Fixierung in Glutaraldehyd ist unerlässlich, da nur so eine adäquate Beurteilung und elektronenmikroskopische Untersuchungen möglich sind.
Liquordiagnostik
Nativer Liquor muß für die zytologische Untersuchung innerhalb einer Stunde nach der Punktion im Institut verarbeitet werden. Bitte verwenden Sie hierfür sterile Röhrchen. In Ausnahmefällen ist es bei bestimmten Fragestellungen (z.B. Meningeosis carcinomatosa) möglich, den Liquor 1:1 mit gepuffertem Formalin versetzt per Post zu verschicken.
Tumordiagnostik
Für Tumorproben ist natives Gewebe wünschenswert, aber nicht notwendig; bei auswärtigen Zusendungen ist hier der Postversand in Plastikgefäßen mit reichlich gepuffertem Formalin der übliche Weg. Für Schnellschnitte ist aber grundsätzlich natives Gewebe erforderlich.
Molekulare Neuropathologie
In unserem Labor werden die folgenden molekular-neuropathologischen Untersuchungen routinemäßig durchgeführt:
Next-Generation Sequencing (NGS)
NGS Custom Panel
Zur parallelen Untersuchung relevanter Mutationen und Genfusionen aus Tumorgewebe führen wir eine NGS Panel Diagnostik durch. Hierfür werden kodierende Abschnitte bestimmter Zielgene (bzw. Introns für die Fusionsanalyse) mittels Hybdrid-Capture Technologie angereichert.
| BRAF (Exon 15) | BCOR (Exon 15) | CD79B (Exon 5) | CDKN2A (Exon 1-3) | CDKN2B (Exon 1-2) |
| CTNNB1 (Exon 3) | DICER1 (Exon 3-28) | EGFR (Exon 1-28) | ERBB2/HER2 (Exon 1-27) | FGFR1 (Exon 2-19) |
| GNA11 (Exon 4-5) | GNAQ (Exon 4-5) | GNAS (Exon 8) | H3F3A (Exon 2) | H3F3B (Exon 2) |
| HIST1H3B (Exon 1) | IDH1 (Exon 4) | IDH2 (Exon 4) | KIT (Exon 1-21) | KRAS (Exon 2-4) |
| MET (Exon 14) | MYD88 (Exon 5) | NRAS (Exon 2-5) | PTEN (Exon 1-9) | RET (Exon 1-20) |
| SMARCB1 (Exon 1-9) | TERT (Promotor) | TP53 (Exon 2-11) | PDGFRA (Exon 2-23) | PDGFRB (Exon 2-23) |
| PIK3CA (Exon 2-21) |
| ALK (Intron 17-19) | BRAF (Intron 7-10) | CD74-NRG1 und CD74-ROS1 (CD74 Intron 4-7) | EGFR (Intron 7,17,24-26) | EWSR1 (Intron 8-14) |
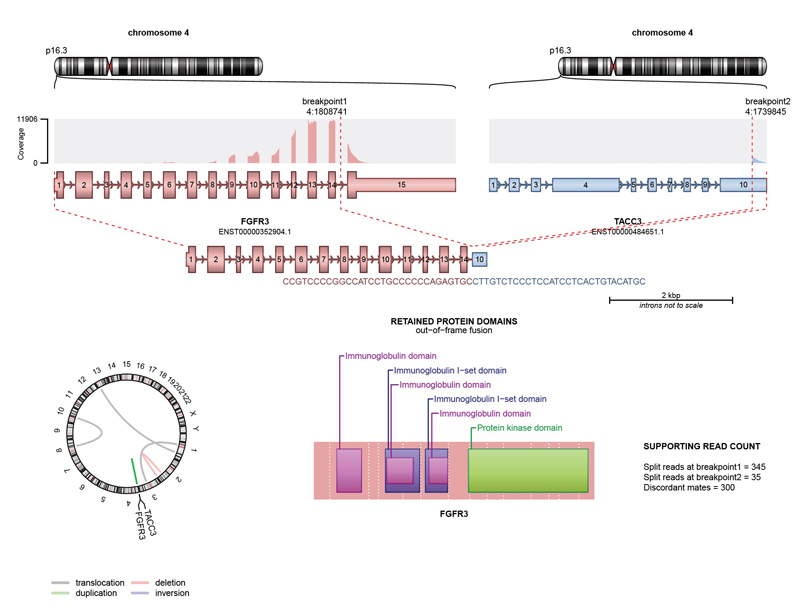
| FGFR1 (Intron 15-18) | FGFR2 (Intron 15-17) | FGFR3 (Intron 17-18) | MET (Intron 13-14) | NTRK1 (Intron 3,7-12) |
| NTRK2 (Intron 15) | NTRK3-ETV6 (ETV6 Intron 4-5) | RELA (Intron 1-2) | RET (Intron 7-11) | ROS1 (Intron 30-35) |
Whole-Exome Sequencing (WES)
Zusätzlich führen wir eine Whole-Exome Diagnostik durch (Hybdrid-Capture Technologie mit Twist Exome 2.0). Bei der Auswertung werden folgende Gene analysiert. Auf Anfrage können nachträglich auch weitere Genabschnitte untersucht werden.
Gliome und glioneuronale Tumoren: ACVR1, AKT1, AKT3, ALK, ATRX, BCOR, BCORL1, BEND2, BRAF, CCND1, CCND2, CCND3, CDK4, CDK6, CDKN2A/B, CDKN2C, CIC, EGFR, FGFR1, FGFR2, FGFR3, FUBP1, H3F3A, HIST1H3B, HIST1H3C, IDH1, IDH2, KBTBD4, KRAS, LZTR1, MAP2K1, MDM2, MDM4, MET, MLH1, MN1, MSH2, MSH6, MTOR, MYB, MYBL1, MYC, MYCN, NF1, NF2, NIPBL, NOTCH1, NRAS, NTRK1, NTRK2, NTRK3, PDGFRA, PIK3CA, PIK3R1, PMS2, PPM1D, PRKCA, PTPN11, RAF1, RB1, RELA, ROS1, SETD2, SMARCA4, STAG2, TERT, TCF12, TSC1, TSC2, TP53, YAP1, ZBTB20, ZFTA
Medulloblastome und andere embryonale ZNS-Tumoren: APC, BCOR, BCORL1, BEND2, BRCA2, CDK6, CIC, CREBBP, CTNNB1, DDX31, DDX3X, DICER1, DROSHA, FOXR2, GFI1, GFI1B, GLI1, GLI2, IDH1, KBTBD4, KDM6A, KMT2D, MN1, MYC, MYCN, OTX2, PALB2, PRDM6, PRKAR1A, PTCH1, PTEN, RB1, SMARCA4, SMARCB1, SMO, SNCAIP, SUFU, TERT, TP53, TTYH1
Meningeome, Nervenscheidentumore und andere extra-axiale Tumoren: AKT1, ARID1A, BAP1, CDKN2A, DICER1, EED, EWSR1, FUS, KLF4, LZTR1, NF1, NF2, PIK3CA, PIK3R1, POLR2A, PRKAR1A, SMARCB1, SMARCE1, SMO, STAT6, SUFU, SUZ12, TERT, TRAF7
Fett markierte Gene werden nur hinsichtlich Kopienzahlveränderungen / Rearrangements untersucht.
Sanger Sequencing
Folgende Gene können zusätzlich via Sanger-Sequenzierung untersucht werden:
- IDH1/2 Hotspot-Mutationen (jew. Exon 4)
- BRAF V600-Status (Exon 15)
- EGFR (Exon 18-21)
- KRAS G12-Status (Exon 2)
- Histon H3 K27-/G34-Status (H3F3A Exon 2, H3F3B Exon 2, HIST1H3B Exon 1)
- FGFR1 (Exon 12, 14)
MGMT Promotor Methylierung (MS-PCR)
Der Methylierungsstatus der 5'-Region des O-6-Methylguanin-DNA-Methyltransferase-Gens (MGMT) ist ein prädiktiver Marker bei malignen Gliomen. Zur Bestimmung wird bisulfitkonvertierte DNA mittels methylierungsspezifischer PCR analysiert (Beier et al. Cancer Res. 2008;68:5706-15).
Nanopore-Methylierungsanalyse
Für die molekulare Klassifikation von Hirntumoren kann die DNA-Methylierung mittels Oxford Nanopore Sequenzierung analysiert werden. Dabei werden die Methylierungsdaten einer Tumorprobe mit einer umfangreichen Referenzdatenbank von Tumoren verglichen (Capper et al. 2018).
Diese Methode ermöglicht die Bestimmung von Methylierungsprofilen direkt aus DNA-Proben, ohne dass eine vorherige chemische Modifikation notwendig ist. Sie ist sowohl für DNA aus Frischgewebe geeignet (Kuschel et al. 2023) als auch für DNA, die aus Formalin-fixiertem, paraffineingebettetem (FFPE) Gewebe gewonnen wurde (Afflerbach et al. 2024).
Die Auswertung der Methylierungsdaten erfolgt mit Hilfe der „Sturgeon“-Software, die die Daten mit dem 11b4 Referenzset des Heidelberger Hirntumor-Classifiers abgleicht (Vermeulen et al. 2023).

Zusätzlich kann mit der Methode ein genomweites Kopienzahlprofil (CNV-Profil) erstellt werden. Hiermit können unter anderem folgende genetische Alterationen detektiert werden:
- Chr1p/19q Ko-Deletion bei Oligodendrogliomen
- +Chr7/-Chr10 bei malignen Gliomen
- EGFR-Amplifikation (z. B. bei malignen Gliomen)

Klonalitätsanalyse
Für die Diagnostik von Lymphomen werden folgende Untersuchungen zum Nachweis einer Klonalität durchgeführt.
- Klonalität des Immunglobulin-Schwerketten-Lokus (IgH) (Biomed-2-IgH-Primermixe)
- Klonalität des T-Zell-Rezeptorgens (TCRG) (IdentiClone T Cell Receptor Gamma Gene Rearrangement Assay 2.0, Invivoscribe)
Erregerdiagnostik
Metagenomics
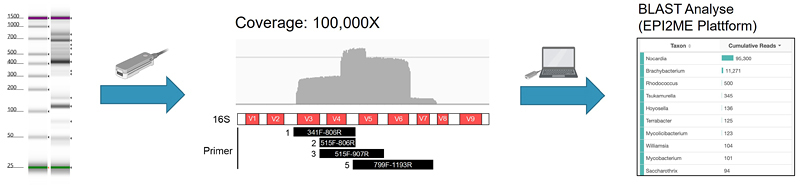
Zur molekularen Identifikation von Erregern führen wir eine Metagenom-Sequenzierung mittels Oxford Nanopore durch. Zum Nachweis von Bakterien werden hierfür mehrere Abschnitte des 16S-Gens mittels PCR amplifiziert.
TBC Nachweis
Zum gezielten Nachweis von Mycobacterium tuberculosis führen wir eine Sanger-Sequenzierung des IS6110 Gens durch.
Konsiliarische Diagnostik
In einzelnen Fällen wird vom Institut für Neuropathologie selbständig ein Konsil von einem Referenzzentrum oder von einem anderen anerkannten Experten erbeten (Liste Konsilpartner (PDF)). Der Einsender wird im Begutachtungsbericht über die Konsilanforderung und das ausgewählte Referenzzentrum informiert. Sofern Einsender oder Patient der Konsilanforderung nicht widersprechen, stimmen sie der Daten- und Gewebeweitergabe an das Referenzzentrum zu.
Das Institut für Neuropathologie ist selbst umfangreich konsiliardiagnostisch und im Rahmen von Therapiestudien referenzpathologisch tätig. Der Leiter des Instituts ist assoziiertes Mitglied des Hirntumor-Referenzzentrums.


